| 2020 ─Ļ╩└Įń╩«┤¾┐Ų╝╝▀M(j©¼n)š╣ą┬┬ä |
|
| └õā÷ļŖńR╝╝ąg(sh©┤)═╗ŲŲįŁūėĘų▒µ┬╩šŽĄK |
|
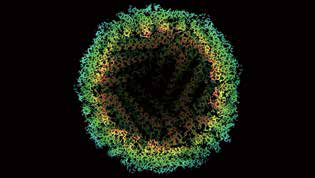
└õā÷ļŖńRĮę╩Š┴╦╚źĶFĶFĄ░░ūĄ─įŁūė╝Ü(x©¼)╣Ø(ji©”)
╚ń╣¹Žļ└LųŲ│÷Ą░░ū┘|(zh©¼)ūŅ╬óąĪĄ─▓┐Ęų����Ż¼┐ŲīW(xu©”)╝ę═©│ŻąĶę¬╩╣öĄ(sh©┤)░┘╚féĆ(g©©)å╬éĆ(g©©)Ą░░ū┘|(zh©¼)Ęųūė┼┼┴ą│╔Š¦¾w���Ż¼╚╗║¾ė├X╔õŠĆŠ¦¾wīW(xu©”)Ęų╬÷╦³éā�Ż╗╗“š▀┐ņ╦┘└õā÷Ą░░ū┘|(zh©¼)Ą─Ė▒▒Š���Ż¼╚╗║¾ė├ļŖūė▐Zō¶╦³éā�����Ż¼▀@╩Ūę╗ĘNĄ═Ęų▒µ┬╩Ą─ĘĮĘ©����Ż¼Įąū÷└õā÷ļŖńR╝╝ąg(sh©┤)ĪŻ
ō■(j©┤)ĪČ┐ŲīW(xu©”)ĪĘł¾(b©żo)Ą└�����Ż¼¼F(xi©żn)į┌��Ż¼┐ŲīW(xu©”)╝ęéāĄ┌ę╗┤╬īó└õā÷ļŖńRĄ─Ęų▒µ┬╩╠ßĖ▀ĄĮįŁūė╦«ŲĮ�����Ż¼ęįŠ½┤_Č©╬╗Ė„ĘNĄ░░ū┘|(zh©¼)ųąå╬éĆ(g©©)įŁūėĄ─╬╗ų├�����Ż¼ŲõĘų▒µ┬╩┐╔┼cX╔õŠĆŠ¦¾wīW(xu©”)ŽÓµŪ├└���ĪŻ
Ė³╝čĄ─Ęų▒µ┬╩£╩(zh©│n)┤_Įę╩Š┴╦Å═(f©┤)ļsĄ─╝Ü(x©¼)░¹ÖC(j©®)Ų„╩Ū╚ń║╬╣żū„Ą─�Ż¼▀@ęŌ╬Čų°└õā÷ļŖńRĄ─Ė─▀M(j©¼n)┐╔─▄Ģ■(hu©¼)Įo╔·╬’īW(xu©”)ĦüĒ¤oöĄ(sh©┤)ą┬ęŖĮŌ��ĪŻ
×ķ┴╦└LųŲĄ░░ū┘|(zh©¼)ĮY(ji©”)śŗ(g©░u)łD��Ż¼┐ŲīW(xu©”)╝ęÅ─20╩└╝o(j©¼)50─Ļ┤·─®Š═ķ_╩╝╩╣ė├X╔õŠĆŠ¦¾wīW(xu©”)�����ĪŻĮĶų·X╔õŠĆ▐Zō¶ĮY(ji©”)Š¦╗»Ą─Ą░░ū┘|(zh©¼)Ż¼▓óĘų╬÷X╔õŠĆĄ─Ę┤ÅŚĘĮ╩Į�����Ż¼┐ŲīW(xu©”)╝ę┐╔ęįėŗ(j©¼)╦Ń│÷Ą░░ū┘|(zh©¼)┐╔─▄Ą─śŗ(g©░u)│╔║═ą╬ĀŅ���ĪŻÄū╩«─ĻüĒ����Ż¼X╔õŠĆ╩°���Īó╠Į£yŲ„║═ėŗ(j©¼)╦ŃÖC(j©®)─▄┴”Ą─Ė─▀M(j©¼n)╩╣▀@ĘNĘĮĘ©ūāĄ├┐ņ╦┘Č°£╩(zh©│n)┤_ĪŻ
Ą½╩Ū�����Ż¼«ö(d©Īng)?sh©┤)░░ū┘|(zh©¼)╠žäe┤¾��Īóį┌║╦╠Ū¾wĄ╚Å═(f©┤)ļsĄ─Łh(hu©ón)Š│ųą╣żū„╗“š▀▓╗─▄ĮY(ji©”)Š¦Ģr(sh©¬)�����Ż¼▀@ĘNĘĮĘ©Š═▓╗─▄║▄║├Ąž░l(f©Ī)ō]ū„ė├ĪŻ
蹊┐╚╦åT╩╣ė├└õā÷ļŖńRī”▓╗ąĶę¬ĮY(ji©”)Š¦Ą─└õā÷Ą░░ū┘|(zh©¼)Ė▒▒Š░l(f©Ī)╔õļŖūė���Ż¼╠Į£yŲ„ėøõøļŖūėĄ─Ų½ęŲ�Ż¼Š½├▄Ą─▄ø╝■īółDŽ±“┐p║Ž”į┌ę╗Ų��Ż¼ę▓┐╔ėŗ(j©¼)╦Ń│÷Ą░░ū┘|(zh©¼)Ą─ĮM│╔║═ą╬ĀŅ��ĪŻ
┤╦Ū░����Ż¼╚š▒ŠĄ─蹊┐╚╦åTęčĮø(j©®ng)▒Ē├„Ż¼╦¹éā┐╔ęįīóę╗ĘNĮąū„╚źĶFĶFĄ░░ūĄ──cĄ└Ą░░ū┘|(zh©¼)Ą─Ęų▒µ┬╩┐sąĪų┴1.54░Ż——▀@▀Ćø]ėą▀_(d©ó)ĄĮ┐╔ęįģ^(q©▒)Ęųå╬éĆ(g©©)įŁūėĄ─│╠Č╚��ĪŻ
¼F(xi©żn)į┌���Ż¼į┌ļŖūė╩°╝╝ąg(sh©┤)��Īó╠Į£yŲ„║═▄ø╝■▀M(j©¼n)ę╗▓ĮĄ─Ä═ų·Ž┬�����Ż¼üĒūįėóć°║═Ą┬ć°Ą─ā╔ĮM蹊┐╚╦åTęčĮø(j©®ng)īóĘų▒µ┬╩┐sąĪĄĮ1.25░���Ż╗“Ė³ąĪ��Ż¼▀@ęčĮø(j©®ng)ūŃęįėŗ(j©¼)╦Ń│÷å╬éĆ(g©©)įŁūėĄ─╬╗ų├�����ĪŻ
į÷ÅŖ(qi©óng)Ą─Ęų▒µ┬╩╗“╩╣Ė³ČÓĄ─ĮY(ji©”)śŗ(g©░u)╔·╬’īW(xu©”)╝ę▀xō±╩╣ė├└õā÷ļŖńR╝╝ąg(sh©┤)���ĪŻ─┐Ū░Ż¼▀@ĒŚ(xi©żng)╝╝ąg(sh©┤)ų╗▀mė├ė┌«É│Żłį(ji©Īn)ė▓Ą─Ą░░ū┘|(zh©¼)����ĪŻŽ┬ę╗▓ĮŻ¼čąŠ┐╚╦åTīó┼¼┴”į┌äéąį▌^ąĪ�Īó▌^┤¾Ą─Ą░░ū┘|(zh©¼)Å═(f©┤)║Ž╬’Ż©╚ń╝¶Įė¾wŻ®ųą▀_(d©ó)ĄĮŅÉ╦ŲŪÕ╬·│╠Č╚Ą─Ęų▒µ┬╩ĪŻŽÓĻP(gu©Īn)šō╬─ė┌2020─Ļ10į┬21╚š░l(f©Ī)▒Ēį┌ĪČūį╚╗ĪĘ���ĪŻĪ÷
ĪČ┐ŲīW(xu©”)ą┬┬äĪĘ (┐ŲīW(xu©”)ą┬┬ä2021─Ļ2į┬į÷┐» Š█Į╣)